Pile Daniell

Pour les articles homonymes, voir Daniell.

La pile Daniell est un dispositif électrochimique réalisant la conversion d'énergie chimique en énergie électrique par le biais d'une réaction d'oxydo-réduction. Le principe de fonctionnement de cette pile a été démontré par Edmond Becquerel et a été perfectionnée par le chimiste britannique John Daniell en 1836, au moment où le développement du télégraphe faisait apparaître un besoin urgent de sources de courant sûres et constantes.
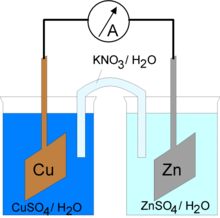
La pile électrique Daniell est constituée d'une anode (lame de zinc plongée dans une solution contenant du sulfate de zinc) et d'une cathode (lame de cuivre plongée dans une solution contenant du sulfate de cuivre). Les deux solutions sont reliées par un pont salin (solution de chlorure de potassium ou de nitrate de potassium ) qui sert à équilibrer les charges. La pile Daniell vient corriger certains défauts de la pile Volta : elle est simple de construction, commode d'usage et sa tension est constante, si bien qu'elle servit pendant longtemps de pile étalon en laboratoires[1].
Étude des deux demi-piles
Demi-pile du zinc
Le couple est impliqué dans la demi-équation d'oxydo-réduction :
L'équation de Nernst qui lui est associée est :
où le potentiel standard vaut :
.
Aussi, le potentiel de l'électrode de zinc est donc :
- [2].
Demi-pile du cuivre
Le couple est impliqué dans la demi-équation d'oxydo-réduction :
L'équation de Nernst qui lui associée est :
où le potentiel standard vaut :
- .
Aussi, le potentiel de l'électrode de cuivre est donc :
- [3].
Prévision de l'évolution chimique
La « règle du gamma » impose une équation bilan de la réaction :
La constante K de cette réaction est de l'ordre de , c'est-à-dire que tant que le quotient de cette réaction est inférieur à K, la réaction évolue dans le sens direct, c’est-à-dire dans le sens de la consommation des réactifs.
Ainsi, il y a :
- oxydation du zinc (l'électrode de zinc est une anode) ;
- et réduction des ions cuivre II (l'électrode de cuivre est une cathode).
Fonctionnement électrochimique

À l'anode
La réaction d'oxydation d'un atome de zinc de l'anode entraîne la libération de deux électrons dans le circuit :
Le potentiel de l'électrode de zinc est le plus bas, c'est le pôle – de la pile :
- .
Dans les fils électriques
Les électrons libérés se dirigent alors vers l'autre électrode de la pile (le pôle +) en créant un courant dans le circuit. Ce courant est conventionnellement positif du pôle + vers le pôle – , alors que les électrons se dirigent du pôle – vers le pôle + (car les électrons sont chargés négativement).
La tension aux bornes de la pile (c’est-à-dire la différence de potentiel entre ses électrodes) est .
À la cathode
Arrivés à la cathode, les électrons sont impliqués dans la réduction des ions cuivre II présents dans la solution :
Ce qui entraîne la croissance de la lame de cuivre.
Le potentiel de l'électrode de cuivre est le plus haut, c'est le pôle + de la pile :
- .
Dans le pont électrolytique
Dans le pont électrolytique (ou pont salin),
- deux anions chlorure () - ou nitrate () dans le cas d'un pont salin à base de - dérivent vers la solution de sulfate de zinc ;
- alors que deux cations potassium () traversent le pont salin pour rééquilibrer la solution de cuivre.
Le pont électrolytique sert ainsi à fermer le circuit électrique, tout en assurant aux deux demi-piles des potentiels différents.
Avantages de la pile Daniell sur la pile Volta
La pile Volta qui lui a précédé ne fournissait pas une tension constante sur la durée. Plusieurs causes sont à l'origine de cette baisse, généralement dénommées « polarisation » : modification de la composition de l'électrolyte au cours de la réaction électrochimique, formation d'hydrogène sur la lame de cuivre qui tend à augmenter la résistance interne de la pile. Ces défauts limitaient beaucoup les applications pratiques de la pile Volta[4].
La pile Volta utilisait une électrode en zinc, l'autre en cuivre (comme la pile Daniell) mais l'électrolyte employé était initialement de la saumure, puis fut remplacé par de l'acide sulfurique. Au niveau de l'électrode de cuivre d'une pile Volta les deux protons H+ de l'acide sulfurique captent les électrons pour former du H2 gazeux.
En remplaçant l'acide sulfurique par du sulfate de cuivre, dans laquelle plonge l'électrode de cuivre, Daniell constate que la formation de dihydrogène disparaît et à la place se forme du cuivre métallique, qui se dépose sur l'électrode de cuivre[4].

Par ailleurs, Daniell eut l'idée de fabriquer une pile à deux compartiments, séparée par une paroi poreuse (pour permettre le déplacement des ions), avec d'un côté l'électrode en cuivre plongée dans le sulfate de cuivre et de l'autre le zinc avec la solution d'acide sulfurique (plus tard remplacé par du sulfate de zinc)[4].
La paroi poreuse était d'abord faite de gosiers de bœuf, puis plus tard remplacée par des plaques de faïence non vernissées dont on pouvait mieux contrôler la pureté et dont la durée de fonctionnement était plus grande.
Ce fut Moritz Hermann von Jacobi qui eut l'idée de remplacer à l'anode la solution d'acide sulfurique par une solution de sulfate de zinc pour aboutir à la pile de Daniell classique, comme on la présente aujourd'hui dans les ouvrages d'électrochimie. En effet, selon Jakobi, lorsque le cuivre se dépose sur l'électrode, une quantité équivalente d'anions sulfate est libérée, et cette quantité peut s'associer à part égale aux cations zinc résultant de la dissolution de l'anode de zinc.
La Pile Daniell améliorée par Jacobi avait l'avantage d'être simple à construire, Elle resta longtemps en usage, par exemple en télégraphie et du fait de la constance de sa tension, elle a servi de pile de référence dans les laboratoires ou l'industrie[4].
Notes et références
- ↑ Lelivrescolaire fr Éditions, « Une brève histoire des piles | Lelivrescolaire.fr », sur www.lelivrescolaire.fr (consulté le )
- ↑ Sarrazin et Verdaguer 1991, p. 309.
- ↑ Sarrazin et Verdaguer 1991, p. 307.
- ↑ a b c et d Pierre Bianco, De la pile Volta à la conquête de l'espace, Publications de l'Université de Provence, , 266 p. (ISBN 2-85399-432-5)
Annexes
Bibliographie
- Jean Sarrazin et Michel Verdaguer, L’oxydoréduction : concepts et expériences, Paris, Ellipses Marketing, , 320 p. (ISBN 2-7298-9122-6, OCLC 809987401, BNF 35463801).
Articles connexes
Liens externes
Sur les autres projets Wikimedia :
- Pile Daniell, sur Wikimedia Commons
- Animation sur le fonctionnement de la pile Daniell
- Notices dans des dictionnaires ou encyclopédies généralistes
 :
: - Britannica
- Den Store Danske Encyklopædi
- Store norske leksikon
v · m | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Accumulateurs |
| ||||||||||
| Piles | |||||||||||
| Piles à combustible | |||||||||||
| Autres | |||||||||||
| Articles liés |
| ||||||||||
v · m | |
|---|---|
| Généralité | |
| Mesure | |
| Composant |
|
| Notions théoriques |
|
 Portail de la chimie
Portail de la chimie  Portail de l’électricité et de l’électronique
Portail de l’électricité et de l’électronique  Portail de l’énergie
Portail de l’énergie




![{\displaystyle E_{Zn}=E^{\circ }(Zn^{2+}/Zn)+{\frac {R.T}{2.F}}\ln {a(Zn^{2+})}\approx E^{\circ }(Zn^{2+}/Zn)+{\frac {0,059}{2}}\log {\left({\frac {\left[Zn^{2+}\right]}{C^{\circ }}}\right)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/33b4f49856a3c9b5fcbc8e4c227245615fa36327)




![{\displaystyle E_{Cu}=E^{\circ }(Cu^{2+}/Cu)+{\frac {R.T}{2.F}}\ln {a(Cu^{2+})}\approx E^{\circ }(Cu^{2+}/Cu)+{\frac {0,059}{2}}\log {\left({\frac {\left[Cu^{2+}\right]}{C^{\circ }}}\right)}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/863724f8de745a8d04e2a4594ee6775a52d6a236)























