Wykres Ramachandrana
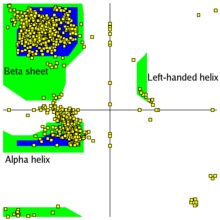
Wykres Ramachandrana – wykres wartości międzycząsteczkowych kątów torsyjnych φ (fi) względem wartości kątów ψ (psi), obrazujący dozwolone i niedozwolone rotacje w łańcuchu peptydowym. Wykres ten zaproponował Gopalasamudrama Narayana Iyer Ramachandran.
Matematycznie jest to wykres funkcji Dziedziną funkcji jest torus; ponieważ standardowy dwuwymiarowy wykres Ramachandrana jest odwzorowaniem torusa na płaszczyźnie, skutkuje to jego pewnym zniekształceniem i nieciągłościami.
Kąt φ określa wielkość rotacji w głównym łańcuchu peptydowym przy wiązaniu peptydowym między atomem azotu a węglem α. Kąt ψ jest natomiast mierzony między węglem α i węglem karbonylowym.
Niedozwolone są te wartości kątów φ-ψ, które powodują przestrzenną zawadę między niezwiązanymi z nimi atomami. Dozwolone kombinacje zaznacza się na wykresie kropkami.
Dla wszystkich L-aminokwasów oprócz proliny i glicyny układają się one w trzy obszary – dozwolone kombinacje charakteryzują helisę α, strukturę β i potrójną helisę cząsteczki kolagenu. Jasne obszary na wykresie odpowiadają takim konformacjom, w których atomy polipeptydu zbliżyłyby się bardziej, niż wynosiłaby suma ich promieni van der Waalsa. Są one przestrzennie niedozwolone dla wszystkich aminokwasów oprócz glicyny, nieposiadającej bocznego łańcucha.
Ponadto w niektórych obszarach wykresu suma odległości między atomami jest tylko nieco mniejsza niż suma promieni van der Waalsa; w takiej sytuacji polipeptyd może utworzyć lewoskrętną α-helisę.
L-aminokwasy nie mogą tworzyć lewoskrętnej helisy, ale obecność reszty glicyny bądź asparaginianu lub asparaginy tworzących wiązanie wodorowe bocznym łańcuchem z głównym łańcuchem polipeptydowym stabilizuje tę niepreferowaną konformację.
Helisa 3,0 jest na krawędzi dozwolonego regionu α-helisy: wskazuje to na jej niższą stabilność. Glicyna nie ma bocznego łańcucha i może adaptować kąty ψ i φ do wszystkich kwadrantów wykresu Ramachandrana. Dlatego też reszta glicynylowa występuje w miejscach zgięć łańcucha polipeptydowego tak często.
Bibliografia
- Robert K. Murray Biochemia Harpera. PZWL, Warszawa 2005 ISBN 83-200-3347-0.
- LubertL. Stryer LubertL., Biochemia. JacekJ. Augustyniak (tłum.), HalinaH. Augustyniak (tłum.), JanJ. Michejda (tłum.), Warszawa: PWN, 2003, ISBN 83-01-13978-1, OCLC 69509816 .
- Donald Voet, Judith G. Voet Biochemistry (3rd ed.) John Wiley & Sons 2003 ISBN 0-471-39223-5.










