Propène
| Propène | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | propène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonymes | méthyléthylène | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 115-07-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.003.693 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 204-062-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No RTECS | UC6740000 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | 8252 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ChEBI | 16052 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SMILES | C(C)=C PubChem, vue 3D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI | Std. InChI : vue 3D InChI=1S/C3H6/c1-3-2/h3H,1H2,2H3 Std. InChIKey : QQONPFPTGQHPMA-UHFFFAOYSA-N | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | gaz comprimé liquéfié incolore[1]. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C3H6 [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire[2] | 42,079 7 ± 0,002 8 g/mol C 85,63 %, H 14,37 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | −185,24 °C[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | −47,69 °C[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | 384 mg l−1 (eau, 20 °C)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 0,609 41 g cm−3 (liquide, −47,69 °C) 1,913 8 kg m−3 (gaz, 0 °C, 1 013 mbar)[4] équation[5] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 485 °C[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | −108 °C[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Limites d’explosivité dans l’air | 1,8–11,2 %vol[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur saturante | 10,14 bar à 20 °C[4] équation[5] :
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point critique | 4 594 kPa[6], 91,75 °C[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp | équation[5] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 2 058,0 kJ mol−1 (25 °C, gaz)[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés électroniques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re énergie d'ionisation | 9,73 ± 0,02 eV (gaz)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés optiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Indice de réfraction | = 1,356 7[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[11] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  Danger H220 : Gaz extrêmement inflammable | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   A, B1, D2B, A : Gaz comprimé pression absolue à 21,1 °C = 1 043 kPa B1 : Gaz inflammable limite inférieure d'inflammabilité = 2,0 % D2B : Matière toxique ayant d'autres effets toxiques mutagénicité chez l'animal Divulgation à 1,0 % selon les critères de classification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4 1 1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Code Kemler : 23 : gaz inflammable Numéro ONU : 1077 : PROPYLÈNE Classe : 2.1 Code de classification : 2F : Gaz liquéfié, inflammable ; Étiquette :  2.1 : Gaz inflammables (correspond aux groupes désignés par un F majuscule); Emballage : - | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Classification du CIRC | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Écotoxicologie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | 1,77[13] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Seuil de l’odorat | bas : 23 ppm haut : 68 ppm[14] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
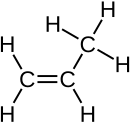
Le propène, anciennement appelé « propylène », est un alcène de formule semi-développée CH2=CH-CH3. Cet important composé de l'industrie pétrochimique est notamment utilisé pour la synthèse d'autres composés plus complexes tels le polypropylène.
Propriétés physico-chimiques
La principale caractéristique du propène est la réactivité de la double liaison qui en fait un bon réactif pour des réactions de polymérisation, d'addition et d'oxydation.
Production et synthèse
Une des principales sources pour le propène est la production d'éthylène où le propène constitue un sous-produit[16]. La fraction C3 issue de la production d'éthylène est isolée et subit une hydrogénation catalysée par du palladium pour éliminer le propyne et le propadiène. Deux étapes de purification sont nécessaires pour éliminer les oligomères et le méthane. À ce stade du procédé, le propène de qualité chimique (92-95 %mol de propène) est produit. Pour obtenir une qualité supérieure nécessaire aux réactions de polymérisation (99,5-99,8 %mol de propène), la séparation du propane est effectuée dans une colonne de rectification voire deux en fonction de l'équipement disponible[16].
Une autre source est le craquage dans les raffineries où la fraction C3-C4 est isolée via une colonne de distillation qui récupère la fraction C2 suivie d'un lavage à l'aide d'essence pour éliminer la fraction C5 et autres composés plus lourds. Une dernière rectification sépare le propène du propane[16].
Le propène peut être également synthétisé comme produit principal via la déshydrogénation du propane à l'aide d'un catalyseur en platine ou en chrome avec un rendement supérieur à 90 %[16]. Plusieurs procédés sont habituellement utilisés pour ce type de réaction : le procédé Oleflex, le procédé Houdry-Catofin, le procédé Phillips STAR et le procédé Linde[16].
Utilisation
Le propène est une des plus importantes matières premières dans l'industrie chimique[réf. nécessaire] et sert à la fabrication de nombreux produits chimiques : acroléine, acrylonitrile, acide acrylique[17], dérivés allyliques, polypropylène, propan-2-ol, 1,2-époxypropane et cumène. Le propylene est également un intermédiaire dans l'oxydation sélective au propane en une étape en acide acrylique[18],[19],[20].
Présence dans l'espace
La sonde Cassini, en utilisant son spectromètre infrarouge, a découvert du propène sur Titan, la plus grosse lune de Saturne[21].
Notes et références
- ↑ PROPYLENE, Fiches internationales de sécurité chimique
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b et c (en) W. M Haynes, Handbook of chemistry and physics, Boca, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 3-442.
- ↑ a b c d e f et g Entrée « Propene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 26 juillet 2011 (JavaScript nécessaire).
- ↑ a b et c (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- ↑ (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Pressures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 35, no 4, , p. 1461 (DOI 10.1063/1.2201061).
- ↑ (en) Iwona Owczarek et Krystyna Blazej, « Recommended Critical Temperatures. Part I. Aliphatic Hydrocarbons », J. Phys. Chem. Ref. Data, vol. 32, no 4, , p. 1411 (DOI 10.1063/1.1556431).
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur monographs.iarc.fr, CIRC, (consulté le ).
- ↑ Numéro index 601-011-00-9 dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- ↑ « Propylène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009.
- ↑ « Kow databank » (consulté le ).
- ↑ « Propylene », sur hazmap.nlm.nih.gov (consulté le ).
- ↑ « base de données ESIS » (consulté le ).
- ↑ a b c d et e (en) Peter Eisele et Richard Killpack, Propene, Wiley-VCH Verlag, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a22_211, présentation en ligne).
- ↑ (en) Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts, (lire en ligne), p. 1, 4, 5.
- ↑ (en) « The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts », Journal of Catalysis, vol. 311, , p. 369-385 (DOI 10.1016/j.jcat.2013.12.008, lire en ligne).
- ↑ (en) « Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol », ACS Catalysis, vol. 3, no 6, , p. 1103-1113 (DOI 10.1021/cs400010q, lire en ligne).
- ↑ (en) « Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid », Journal of Catalysis, vol. 285, , p. 48-60 (DOI 10.1016/j.jcat.2011.09.012, lire en ligne).
- ↑ « La sonde Cassini découvre un ingrédient du plastique dans l'espace », Atlantico, (consulté le ).
Voir aussi
 Portail de la chimie
Portail de la chimie


















