Oxalate de calcium
| Oxalate de calcium | |||
 | |||
| Identification | |||
|---|---|---|---|
| No CAS | 563-72-4 (anhydre) 5794-28-5 (monohydrate) | ||
| No ECHA | 100.008.419 | ||
| No CE | 209-260-1 | ||
| PubChem | 33005 | ||
| SMILES | [O-]C(=O)C(=O)[O-].[Ca+2] PubChem, vue 3D | ||
| InChI | InChI : vue 3D InChI=1/C2H2O4.Ca/c3-1(4)2(5)6;/h(H,3,4)(H,5,6);/q;+2/p-2 | ||
| Propriétés chimiques | |||
| Formule | C2CaO4CaC2O4 | ||
| Masse molaire[1] | 128,097 ± 0,007 g/mol C 18,75 %, Ca 31,29 %, O 49,96 %, | ||
| Propriétés physiques | |||
| T° fusion | 200 °C (monohydrate)[2] | ||
| Solubilité | 0,0006 g/100 g (eau, 18 °C)[3] | ||
| Masse volumique | 2,12 g·cm-3 (monohydrate, 20 °C)[2] | ||
| Précautions | |||
| NFPA 704 | |||
0 3 1 | |||
| Directive 67/548/EEC | |||
 Xn Symboles : Xn : Nocif Phrases R : R20/21/22 : Nocif par inhalation, par contact avec la peau et par ingestion. R36/37/38 : Irritant pour les yeux, les voies respiratoires et la peau. Phrases S : S26 : En cas de contact avec les yeux, laver immédiatement et abondamment avec de l’eau et consulter un spécialiste. S37/39 : Porter des gants appropriés et un appareil de protection des yeux/du visage. Phrases R : 20/21/22, 36/37/38, Phrases S : 26, 37/39, | |||
| Transport | |||
Code Kemler : 60 : matière toxique ou présentant un degré mineur de toxicité Numéro ONU : 3288 : SOLIDE INORGANIQUE TOXIQUE, N.S.A. Classe : 6.1 Code de classification : T5 : Matières toxiques sans risque subsidiaire : Inorganiques, solides ; Étiquette :  6.1 : Matières toxiques Emballage : Groupe d'emballage III : matières faiblement dangereuses. | |||
| Écotoxicologie | |||
| DL50 | 375 mg·kg-1 (rat, oral)[4] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
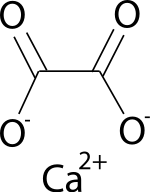
L'oxalate de calcium est un cristal ionique insoluble dans l'eau, de formule Ca(COO)2 ou CaC2O4, composé d'un ion calcium Ca2+ et d'un ion oxalate −OOC-COO−, dérivé de l'acide oxalique.
70 à 80 % du contenu de la plupart des calculs rénaux sont composés d'oxalate de calcium dihydraté (calculs plutôt jaunes avec de petites aspérités) ou monohydraté (calculs plutôt noirs).
Sources, présence
On le rencontre dans les minéraux :
- whewellite (monohydrate),
- weddellite (dihydrate),
- caoxite (trihydrate),
On le rencontre aussi dans les biofilms où il se forme sous l'action des champignons qui sécrètent l'acide oxalique et de la carbonatogénèse bactérienne (en).
Il est présent aussi chez certaines plantes calcicoles qui tolèrent le calcium toxique[5] grâce aux hyphes mycéliens rejetant activement vers l'extérieur les ions Ca2+ ou secrétant de l'acide oxalique qui les immobilise sous forme de cristaux d'oxalate de calcium qui précipitent sur les parois des hyphes, dans les vacuoles ou dans les idioblastes où ils peuvent prendre la forme de spicules ou raphides, ce qui occasionne de sévères irritations des muqueuses aux herbivores qui tenteraient d’en manger[6],[7] :
- bulbes de la famille des liliacées (occasionnant des dermatites à ceux qui manipulent ces bulbes en grande quantité),
- vacuoles chez des Asparagacées (asperges)
- baies d'arbouse ou de Myrica,
- aracées (tubercules et feuilles crus de Taro - Colocasia esculenta),
- sève de jonquille,
- lentilles d'eau (lemna minor),
- feuilles de la rhubarbe (qui en contient à des doses toxiques),
- Jussie rampante (plante introduite en Europe, devenue invasive),
- yucca[8],
- oseille,
- Carambole,
- Iroko,
- bois du Ginkgo biloba.
On le rencontre également dans de nombreuses sources alimentaires : chocolat, fruits secs, épinards, oseille, thé.
Voir aussi
Articles connexes
Liens externes
- Analyse thermique de la décomposition d'oxalate de calcium et suite
Bibliographie

Notes et références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b c et d (de) [PDF] Fiche de sécurité (alfa-aesar) (Monohydrate)
- ↑ (en) Wilhelm Riemenschneider et Minoru Tanifuji, Ullmann's Encyclopedia of Industrial Chemistry, Release 2004, 7th Edition, Oxalic Acid, Wiley-VCH Verlag GmbH & Co,
- ↑ (de) [PDF] Fiche de sécurité (Carl Roth GmbH & Co. KG)
- ↑ L'excès de calcium perturbe le fonctionnement et la disposition des molécules des membranes cellulaires.
- ↑ M. Avenel-Audran, « Peau, plantes et jardinage », Revue française d'allergologie, 49:3, 2009. consultable uniquement pour les abonnés
- ↑ (en) Kermit Cromack et al., « The role of oxalic acid and bicarbonate in calcium cycling by fungi and bacteria : some possible implications for soil animals », Ecological Bulletins, no 25, , p. 246-252
- ↑ Photos de raphides d'oxalate de calcium dans des cellules de yucca
v · m | |
|---|---|
|
 Portail de la chimie
Portail de la chimie











