Nitrate de bismuth(III)
| Nitrate de bismuth(III) | |||
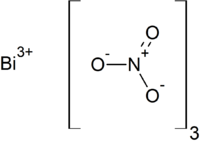 | |||
 | |||
| Nitrate de bismuth. | |||
| Identification | |||
|---|---|---|---|
| No CAS | 1304-85-4 10035-06-0 (pentahydrate) | ||
| No ECHA | 100.030.707 | ||
| No CE | 233-791-8 | ||
| SMILES | [Bi+3].[N+]([O-])(=O)[O-].[N+]([O-])(=O)[O-].[N+]([O-])(=O)[O-].O.O.O.O.O PubChem, vue 3D | ||
| InChI | InChI : vue 3D InChI=1S/Bi.3NO3.5H2O/c;3*2-1(3)4;;;;;/h;;;;5*1H2/q+3;3*-1;;;;; InChIKey : FBXVOTBTGXARNA-UHFFFAOYSA-N | ||
| Propriétés chimiques | |||
| Formule | BiN3O9Bi(NO3)3 | ||
| Masse molaire[1] | 394,995 1 ± 0,003 3 g/mol Bi 52,91 %, N 10,64 %, O 36,45 %, | ||
| Propriétés physiques | |||
| T° fusion | 30 °C[2] | ||
| T° ébullition | 75 à 80 °C[2] | ||
| Solubilité |
| ||
| Masse volumique | 2,83 g·cm-3[2] | ||
| Précautions | |||
| SGH[2] | |||
  H272 : Peut aggraver un incendie ; comburant H315 : Provoque une irritation cutanée H319 : Provoque une sévère irritation des yeux H335 : Peut irriter les voies respiratoires P210 : Tenir à l’écart de la chaleur/des étincelles/des flammes nues/des surfaces chaudes. — Ne pas fumer. P220 : Tenir/stocker à l’écart des vêtements/…/matières combustibles P221 : Prendre toutes précautions pour éviter de mélanger avec des matières combustibles… P261 : Éviter de respirer les poussières/fumées/gaz/brouillards/vapeurs/aérosols. P264 : Se laver … soigneusement après manipulation. P271 : Utiliser seulement en plein air ou dans un endroit bien ventilé. P280 : Porter des gants de protection/des vêtements de protection/un équipement de protection des yeux/du visage. P312 : Appeler un CENTRE ANTIPOISON ou un médecin en cas de malaise. P321 : Traitement spécifique (voir … sur cette étiquette). P362 : Enlever les vêtements contaminés et les laver avant réutilisation P302+P352 : En cas de contact avec la peau : laver abondamment à l’eau et au savon. P304+P340 : En cas d'inhalation : transporter la victime à l’extérieur et la maintenir au repos dans une position où elle peut confortablement respirer. P305+P351+P338 : En cas de contact avec les yeux : rincer avec précaution à l’eau pendant plusieurs minutes. Enlever les lentilles de contact si la victime en porte et si elles peuvent être facilement enlevées. Continuer à rincer. P332+P313 : En cas d’irritation cutanée : consulter un médecin. P337+P313 : Si l’irritation oculaire persiste : consulter un médecin. P370+P378 : En cas d’incendie : utiliser … pour l’extinction. P405 : Garder sous clef. P403+P233 : Stocker dans un endroit bien ventilé. Maintenir le récipient fermé de manière étanche. P501 : Éliminer le contenu/récipient dans … | |||
| NFPA 704[2] | |||
0 2 2 OX | |||
| Transport[2] | |||
| |||
| Écotoxicologie | |||
| DL50 | 71 mg·kg-1 (souris, i.p.)[4] 3 710 mg·kg-1 (souris, oral)[5] 4 042 mg·kg-1 (rat, oral)[5] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
Le nitrate de bismuth(III) est un composé chimique de formule Bi(NO3)3.
Synthèse et réactions
Le nitrate de bismuth peut être préparé par réaction de l'acide nitrique concentré sur le bismuth métallique[6] :
- Bi + 4HNO3 → Bi(NO3)3 + 2H2O + NO.
En solution dans l'acide nitrique, il est facilement hydrolysé en formant des oxynitrates quand le pH augmente au-dessus de 0[7].
Il est également soluble dans l'acétone, l'acide acétique et le glycérol mais pratiquement insoluble dans l'éthanol et l'acétate d'éthyle[8].
Applications
Le nitrate de bismuth possède plusieurs applications industrielles et en laboratoire[3]. Il est notamment utilisé dans certaines peintures lumineuses, ou pour la préparation d'autre sels de bismuth. Le pentahydrate est utilisé comme oxydant pour réagir avec certaines 1,4-dihydropyridines de Hantzsch 4-substitutées. Il sert aussi de réactif dans certains oxydations sélectives de sulfures en sulfoxydes[8]. Il est enfin utilisé dans la préparation du réactif de Dragendorff, lui-même utilisé comme colorant en chromatographie sur couche mince (CCM).
Bi(NO3)3 forme des complexes insolubles avec le pyrogallol et le cupferron, propriété mis à l'œuvre dans des analyses gravimétriques visant à déterminer une quantité de bismuth[9].
La décomposition thermique du nitrate de bismuth peut être utilisée pour produire du dioxyde d'azote, NO2[10].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Bismuth(III) nitrate » (voir la liste des auteurs).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ a b c d e et f Fiche Sigma-Aldrich du composé Bismuth(III) nitrate pentahydrate, consultée le 31 mars 2018.
- ↑ a et b « Fiche du composé Bismuth(III) nitrate pentahydrate, ACS, 98% min », sur Alfa Aesar (consulté le ).
- ↑ Basinger MA, Jones MM, McCroskey SA., « Antidotes for acute bismuth intoxication. », Journal of Toxicology, Clinical Toxicology, vol. 20, , p. 159-165 (PMID 6887308)
- ↑ a et b Gigiena Truda i Professional'nye Zabolevaniya. Labor Hygiene and Occupational Diseases. Vol. 30(6), Pg. 16, 1986.
- ↑ (en) Ronald Rich, Inorganic Reactions in Water (e-book), Berlin, Springer, , 521 p. (ISBN 978-3-540-73962-3, lire en ligne).
- ↑ (en) F. Lazarini, « Thermal dehydration of some basic bismuth nitrates », Thermochimica Acta, vol. 46, no 1, , p. 53–55 (ISSN 0040-6031, DOI 10.1016/0040-6031(81)85076-9).
- ↑ a et b (en) Organobismuth Chemistry, Elsevier, (ISBN 0-444-20528-4).
- ↑ (en) A.I. Vogel, (1951), Quantitative Inorganic analysis, (2d edition), Longmans Green and Co.
- ↑ (en) S.W. Krabbe et R.S. Mohan, Topics in Current chemistry 311, Bismuth-Mediated Organic Reactions, Berlin, Springer, , 100–110 p. (ISBN 978-3-642-27239-4, lire en ligne), « Environmentally friendly organic synthesis using Bi(III) compounds ».
v · m | |||
|---|---|---|---|
| Bismuthures |
| ||
| Sb(0) |
| ||
| Bi(III) |
| ||
| Bi(V) |
| ||
 Portail de la chimie
Portail de la chimie










