Acide succinique
| Acide succinique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
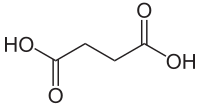 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| formule topologique de l'acide succinique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identification | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nom UICPA | Acide butanedioïque | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | 110-15-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.003.402 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 203-740-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No E | E363 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apparence | cristaux blancs inodores | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés chimiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Formule | C4H6O4 [Isomères] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse molaire[1] | 118,088 ± 0,004 8 g/mol C 40,68 %, H 5,12 %, O 54,19 %, | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 4,16; 5,61 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° fusion | 185 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° ébullition | 235 °C (décomposition) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | eau: 70 g·L-1 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 1,56 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T° d'auto-inflammation | 630 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’éclair | 235 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermochimie | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cp | équation[2] :
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Produit non classé La classification de ce produit n'a pas encore été validée par le Service du répertoire toxicologique Divulgation à 1,0% selon la liste de divulgation des ingrédients | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI et CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
modifier  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

L'acide succinique ou acide butane-1,4-dioïque est un diacide carboxylique aliphatique de formule semi-développée HOOC–CH2–CH2–COOH.
Il est présent dans tous les organismes vivants et intervient dans le métabolisme cellulaire, en particulier dans le métabolisme des lipides entre l'acide α-cétoglutarique et l'acide fumarique lors du cycle de Krebs dans la mitochondrie, pour contribuer à lui fournir de l'énergie.
Origine
L'acide succinique a été extrait pour la première fois du succin ou ambre de la Baltique (ambre jaune), ce qui a contribué à sa dénomination. On le retrouve aussi dans le lignite, mais surtout, cette molécule du vivant, composé indispensable au processus d'oxydo-réduction cellulaire, peut être extrait de divers organismes végétaux et animaux. Citons la laitue vireuse, la grande chélidoine, le trèfle blanc[4] ou encore les organes comme la rate de bœuf ou les déjections cellulaires comme les urines.
Propriétés physico-chimiques
L'acide succinique se présente sous forme de poudre dont le point de fusion est 185 °C. Si on continue à chauffer jusque vers 235 °C, il donne l'anhydride succinique (en) qui se volatilise immédiatement. L'anhydride succinique de formule C4H4O3 est un solide qui fond à 120 °C.
Il réagit facilement avec l'ammoniac NH3 pour donner des succinimides, avec le phénol pour engendrer des succinéides.
L'acide organique aux deux groupes carboxyles peut céder deux protons pour donner l'ion succinate, selon un équilibre acido-basique en solution aqueuse. C'est un acide faible : pKa1 = 4,2 et pKa2 = 5,6.
Rôle biochimique
Le succinate est un composant du cycle de l'acide citrique et est capable de donner des électrons pour la chaîne respiratoire par la réaction :
Cette réaction est catalysée par le complexe II de la chaîne respiratoire.
Une étude métabolomique, en 2014, a trouvé que pour les 14 métabolites les plus discriminants (p < 0,05), l’acide succinique (et l’acide glycolique sont excrétés en plus grande concentration dans les urines par les enfants autistes, alors que d’autres acides organiques (acide hyppurique, acide 3-hydroxyphénylacétique, acide vanillylhydracrylique, acide 3-hydroxyhippurique, acide 4-hydroxyphényl-2-hydroxyacétique, acide 1H-indole- 3-acétique, acide phosphorique, acide palmitique, acide stéarique, acide 3-méthyladipique) étaient, eux, retrouvés en concentrations plus basses[5].
Marché, synthèse et production
L'acide succinique peut servir à synthétiser de nombreuses molécules d'intérêt médical ou commercial (ex : tétrahydrofurane). Son marché potentiel est estimé[6] à plus de 2,5 M€.
Il était produit industriellement à partir de dérivés du pétrole (acétylène et formaldéhyde), mais en 2008, un premier pilote industriel (installé en 2007 dans la bio-raffinerie de Pomacle-Bazancourt près de Reims, disposant d'une capacité de production de 2000t/an) a pu en produire à partir de sucres et résidus lignocellulosiques fermentés par E. Coli en atmosphère enrichie en CO2[7].
Acide succinique et vin
L’acide succinique entre également dans la composition du vin et du vinaigre et est toujours obtenu lors de la fermentation alcoolique du sucre en petites quantités, environ 1 g pour 100 g d’alcool. La formation d'acide succinique et de butane-2,3-diol à partir d’éthanal (acétaldéhyde) peut se résumer de la façon suivante :
- acide succinique :

L'éthanal produit du butane-2,3-diol par condensation avec l'éthanol.
Références
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- ↑ « Acide succinique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- ↑ Frank Bisby, Phytochemical Dictionary of the Leguminosae, Chapman and Hall/CRC, (ISBN 978-1-000-71525-5, lire en ligne)
- ↑ (en) Binta Diémé et Sylvie Mavel, « Metabolomics Study of Urine in Autism Spectrum Disorders Using a Multiplatform Analytical Methodology », Journal of Proteome Research, , p. 5273–5282 (ISSN 1535-3893, DOI 10.1021/acs.jproteome.5b00699, lire en ligne, consulté le ). Voir aussi le Bulletin scientifique de l’Arapi, no 34, hiver 2014 [lire en ligne], p. 44 et suivantes.
- ↑ L'Usine Nouvelle, « Bioamber investit dans la production d'acide succinique d'origine végétale - Quotidien des Usines », usinenouvelle.com/, (lire en ligne, consulté le )
- ↑ Démarrage de la première usine commercial d'acide succinique d'origine vététale; Art. de Biofutur, mars 2010, p. 21
Voir aussi
 Portail de la chimie
Portail de la chimie  Portail de la biochimie
Portail de la biochimie  Portail de la vigne et du vin
Portail de la vigne et du vin
















