Monofluoruro de cloro
 | ||
 | ||
| General | ||
| Otros nombres | clorofluoruro | |
| Fórmula molecular | ClF | |
| Identificadores | ||
| Número CAS | 7790-89-8[1] | |
| InChI InChI=InChI=1S/ClF/c1-2 Key: OMRRUNXAWXNVFW-UHFFFAOYSA-N | ||
| Propiedades físicas | ||
| Apariencia | gas incoloro | |
| Masa molar | 54,45 g/mol | |
| Punto de fusión | 117,5 K (−156 °C) | |
| Punto de ebullición | 173,1 K (−100 °C) | |
| Propiedades químicas | ||
| Momento dipolar | 0.881 D | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
[editar datos en Wikidata] | ||
El monofluoruro de cloro o clorofluoruro es un compuesto químico. Su fórmula química es ClF. Tiene iones de cloro y de flúor. El cloro se encuentra en su estado de oxidación +1.
Obtención y preparación
El clorofluoruro se puede producir calentando una mezcla de cloro y flúor elementales a 250 °C en presencia de virutas de cobre:[2]
También es posible su obtención por reacción del clorotrifluoruro con cloro elemental:[3]
Propiedades
El monofluoruro de cloro es un gas incoloro. Se puede enfriar a un líquido de color amarillo pálido a bajas temperaturas. Muchas de sus propiedades son intermedias a las del cloro y del flúor.[4] Reacciona con agua, metales y muchos compuestos orgánicos. Ataca al vidrio con la formación de óxidos de cloro explosivos.[5] El clorofluoruro se puede usar como reactivo de fluoración de concentración media con el tungsteno para producir hexafluoruro de tungsteno y con el selenio para producir tetrafluoruro de selenio:
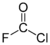
También puede clorofluorar compuestos, ya sea por adición a través de un enlace múltiple o por oxidación. Por ejemplo, agrega flúor y cloro al átomo de carbono del monóxido de carbono, lo cual genera clorofluoruro de carboniloː
- CO + ClF →
Véase también
Referencias
- ↑ Número CAS
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg (1995). Lehrbuch der Anorganischen Chemie. Walter de Gruyter. p. 466. ISBN 3-11-012641-9.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 166.
- ↑ Otto Ruff, E. Ascher (1928). Über ein neues Chlorfluorid-CIF3. Zeitschrift für anorganische und allgemeine Chemie. 176 (1): 258–270. doi:10.1002/zaac.19281760121.
- ↑ Wissenschaft-Online-Lexika: Eintrag zu Chlorfluoride im Lexikon der Chemie; abgerufen am 4. Juni 2009.
 Datos: Q417146
Datos: Q417146 Multimedia: Chlorine monofluoride / Q417146
Multimedia: Chlorine monofluoride / Q417146
















